取消
清空記錄
歷史記錄
清空記錄
歷史記錄


- 主站蜘蛛池模板: 醉酒后少妇被疯狂内射视频| 无码人妻丰满熟妇片毛片| 成av免费大片黄在线观看| 亚洲av精品一区二区三区| 亚洲av色香蕉一区二区三区老师| 在线观看成人无码中文av天堂| 国产又色又爽又黄的| 蜜臀av一区二区| 国产手机在线精品| 性无码专区无码| 亚洲av无码久久精品蜜桃| 人妻聚色窝窝人体www一区| 国产专区免费av无码| 日韩精品人妻系列无码专区| 国产小受呻吟gv视频在线观看| 国产熟妇的荡欲午夜视频| 亚洲av无码专区国产乱码电影| 无码人中文字幕| 国产内射999视频一区| 窝窝午夜看片| 亚洲无线码一区二区三区| 狠狠色噜噜狠狠狠8888米奇| 国产亚洲精品久久久999| 亚洲爆乳成av人在线视菜奈实| 免费夜色污私人影院在线观看| 疯狂做受xxxx国产| 久久精品一区二区三区av| 亚洲国产精品美女久久久久| 不卡av电影在线| 女人被做到高潮免费视频| 亚洲av无码专区在线| 伊人久久大香线蕉无码不卡| 亚洲人成未满十八禁网站| 国产老熟女狂叫对白| 中文人妻av大区中文不卡| 欧美三根一起进三p| 成年免费a级毛片| 亚洲a∨国产av综合av| 午夜免费啪视频| 欧美大胆a级视频免费| 四虎国产精品免费久久|
甩尾測(cè)試儀(甩尾儀)
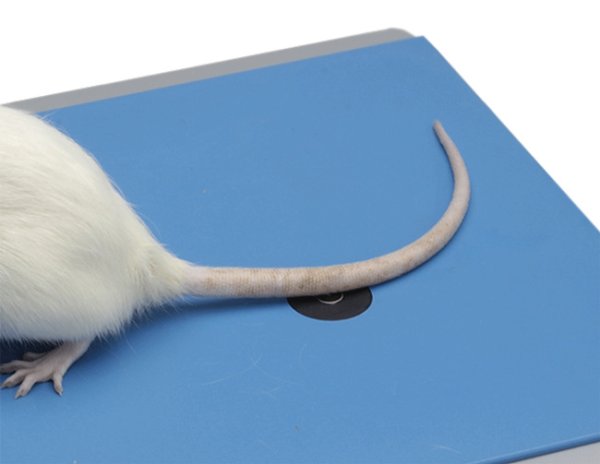
準(zhǔn)確測(cè)量大鼠或小鼠的尾巴對(duì)紅外熱刺激的痛覺(jué)閾值,具有極高的可重復(fù)性,對(duì)于麻醉動(dòng)物同樣適用。 公眾號(hào)
公眾號(hào) 關(guān)注我們
關(guān)注我們 產(chǎn)品詳情
產(chǎn)品詳情準(zhǔn)確測(cè)量大鼠或小鼠的尾巴對(duì)紅外熱刺激的痛覺(jué)閾值,具有極高的可重復(fù)性,對(duì)于麻醉動(dòng)物同樣適用。
疼痛甩尾法起源于D'Amour&Smith 1941年的發(fā)現(xiàn),通過(guò)持續(xù)聚焦光束在動(dòng)物尾巴上造成熱刺激,當(dāng)動(dòng)物感到疼痛時(shí),會(huì)出現(xiàn)典型的尾巴突然抽動(dòng)現(xiàn)象,且具有很高的重復(fù)性。
Ugo Basile甩尾測(cè)試儀可準(zhǔn)確測(cè)量大小鼠尾部對(duì)紅外熱刺激的傷害感受敏感性。通過(guò)測(cè)量對(duì)紅外熱輻射的疼痛反應(yīng)時(shí)間長(zhǎng)短差異進(jìn)行快速篩選鎮(zhèn)痛藥物。標(biāo)配型號(hào)用于大鼠,不包含固定桶,可選小鼠固定筒用于小鼠甩尾測(cè)試。
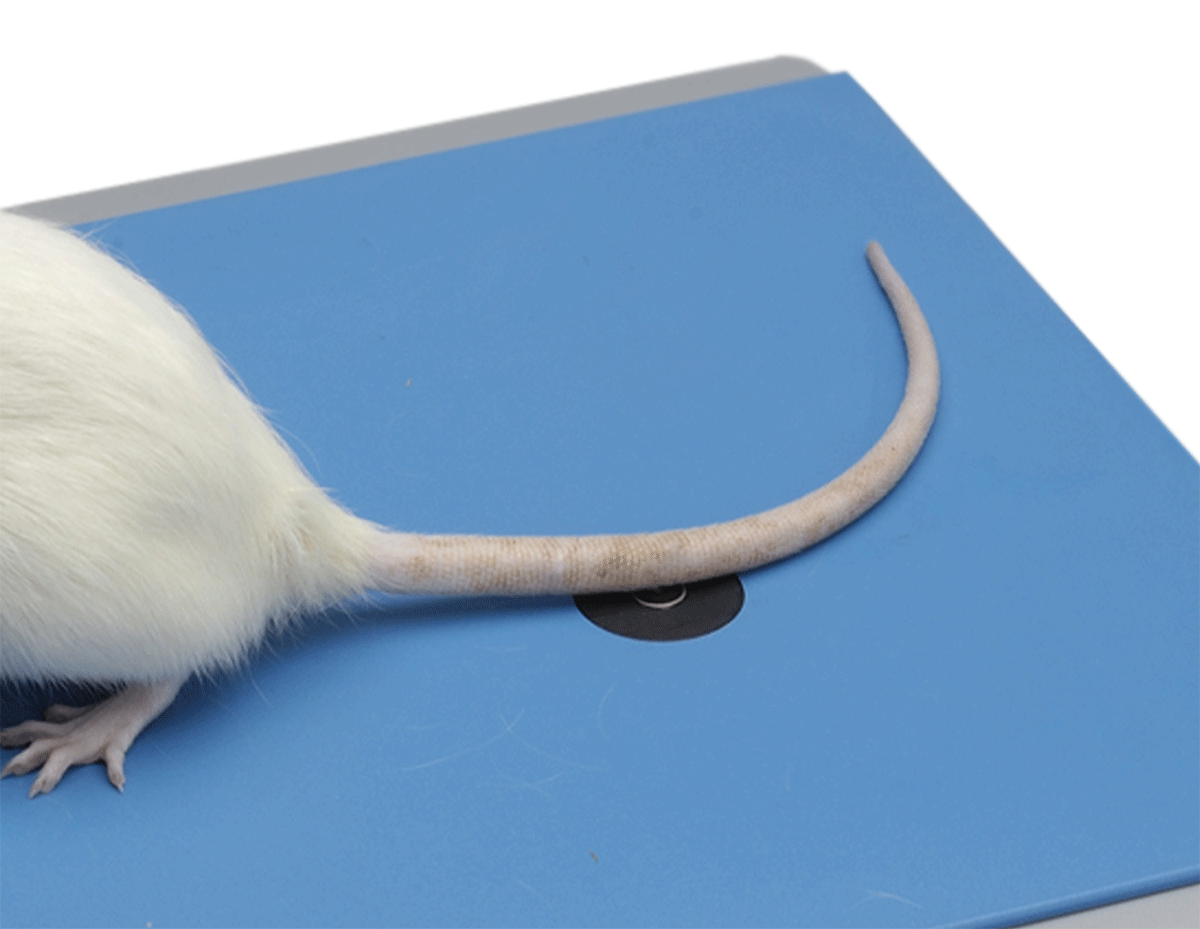
甩尾測(cè)試儀主要由一個(gè)紅外光輻射源,鼠固定筒、控制主機(jī)構(gòu)成,將鼠尾巴放置于紅外光發(fā)射窗口處,設(shè)定好光強(qiáng)后,紅外光通過(guò)凸透鏡聚焦在鼠尾上。當(dāng)老鼠感到疼痛并擺動(dòng)尾巴時(shí),傳感器會(huì)檢測(cè)到終點(diǎn)事件,停止計(jì)時(shí)并自動(dòng)記錄時(shí)長(zhǎng)。
優(yōu)勢(shì)特點(diǎn):
一、中樞神經(jīng)鎮(zhèn)痛藥物篩選的經(jīng)典設(shè)備
中樞神經(jīng)疼痛常涉及脊柱生物化學(xué)變化,疼痛部位常擴(kuò)展到身體多部位,甩尾測(cè)試儀可對(duì)中樞神經(jīng)疼痛鎮(zhèn)痛藥物進(jìn)行快速篩選,在已發(fā)表的SCI論文中引用Ugo Basile 甩尾測(cè)試儀已超過(guò)3000次,是全球使用和驗(yàn)
證最多的疼痛甩尾設(shè)備。
二、測(cè)試結(jié)果真實(shí)性高,鼠尾熱痛絕佳測(cè)試方案
Ugo Basile甩尾測(cè)試儀以D'Amour & Smith方法為設(shè)計(jì)理念,結(jié)合了點(diǎn)刺激和熱刺激的優(yōu)勢(shì),具有對(duì)敏感的鼠尾部位不產(chǎn)生交互行為的特點(diǎn),消除了動(dòng)物應(yīng)激反應(yīng),降低了假陽(yáng)性反應(yīng)的甩尾現(xiàn)象,保證測(cè)試結(jié)
果的真實(shí)性和可重復(fù)性。
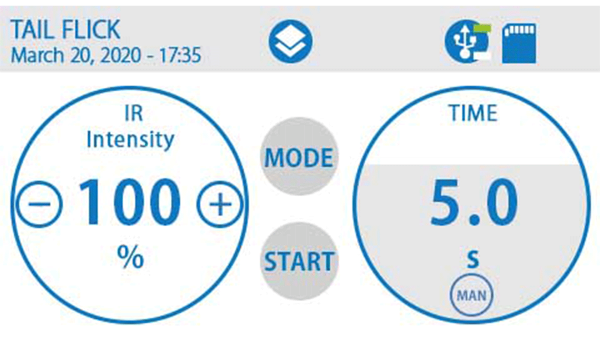
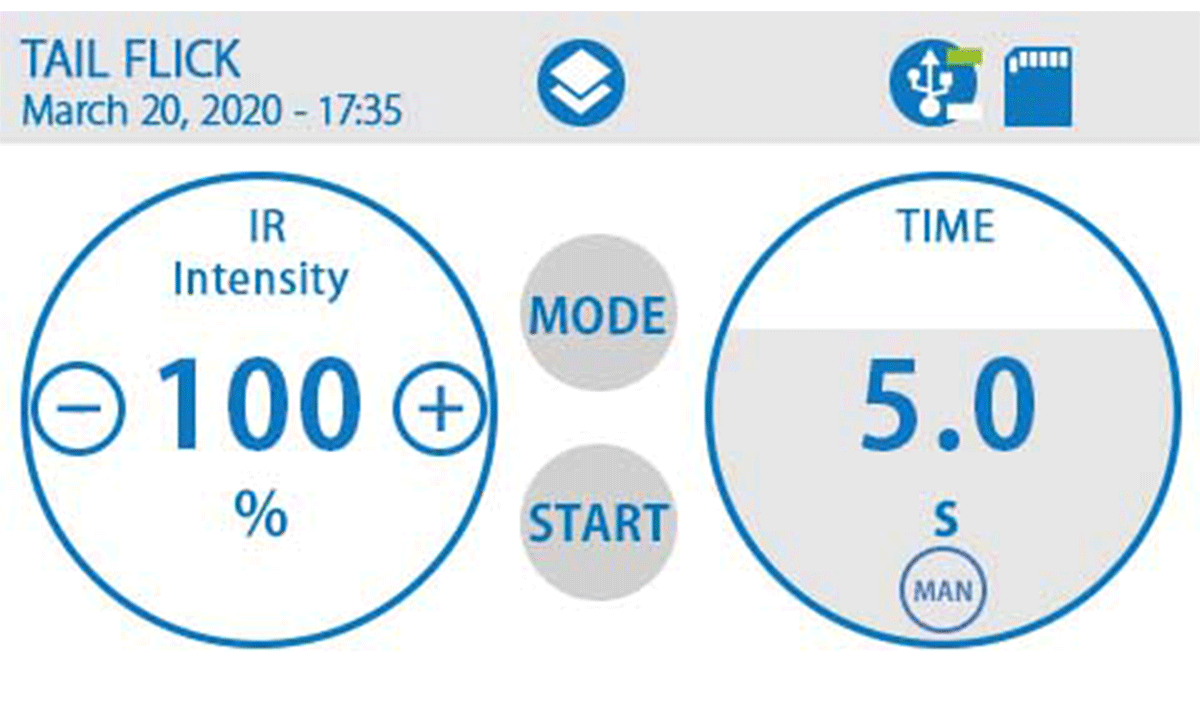
三、紅外刺激光強(qiáng)可調(diào),自動(dòng)或手動(dòng)評(píng)分
紅外刺激光強(qiáng)可設(shè)置范圍為:1%-100%,適用不同動(dòng)物模型。設(shè)備可自動(dòng)檢測(cè)并存儲(chǔ)由疼痛引起的甩尾時(shí)間,也可采用腳踏開(kāi)關(guān)手動(dòng)停止計(jì)時(shí),常用于甩尾難以自動(dòng)測(cè)量的情況。
四、可視化觸摸屏控制和直觀的結(jié)果顯示
4.3"觸屏控制,具有廣泛的參數(shù)設(shè)置范圍、用戶友好的觸屏控制模式和直觀的結(jié)果顯示,測(cè)試結(jié)果實(shí)時(shí)存儲(chǔ)并可于屏幕上直觀查閱,也可通過(guò)U盤(pán)一鍵導(dǎo)出電子表格方便保存和數(shù)據(jù)處理。

應(yīng)用領(lǐng)域:
甩尾測(cè)試儀可以準(zhǔn)確測(cè)量大小鼠尾巴對(duì)紅外熱刺激的疼痛閾值,廣泛應(yīng)用于疼痛炎癥相關(guān)機(jī)制研究,各類(lèi)中樞神經(jīng)痛及外周神經(jīng)痛的藥物鎮(zhèn)痛效果評(píng)價(jià)。


型號(hào)規(guī)格:
37560
甩尾測(cè)試儀大鼠完整套裝,包含主機(jī)、腳踏開(kāi)關(guān)、U盤(pán)。
37360-325
小鼠固定筒,內(nèi)徑25mm(選配)
37360-330
小鼠固定筒,內(nèi)徑30mm(選配)
37300
紅外光測(cè)量?jī)x校準(zhǔn)計(jì)(選配)
參考文獻(xiàn):
1.Guida F, Boccella S, Belardo C, et al. Altered gut microbiota and endocannabinoid system tone in vitamin D deficiency-mediated chronic pain. Brain Behav Immun. 2020;85:128-141. doi:10.1016/j.bbi.2019.04.006
2.Xue N, Wu X, Wu L, Li L, Wang F. Antinociceptive and anti-inflammatory effect of Naringenin in different nociceptive and inflammatory mice models. Life Sci. 2019;217:148-154. doi:10.1016/j.lfs.2018.11.013
3.Hu ZJ, Han W, Cao CQ, Mao-Ying QL, Mi WL, Wang YQ. Peripheral Leptin Signaling Mediates Formalin-Induced Nociception. Neurosci Bull. 2018;34(2):321-329. doi:10.1007/s12264-017-0194-2
4.Pieretti S, Saviano A, Mollica A, Stefanucci A, Aloisi AM, Nicoletti M. Calceolarioside A, a Phenylpropanoid Glycoside from Calceolaria spp., Displays Antinociceptive and Anti-Inflammatory Properties. Molecules. 2022;27(7):2183. Published 2022 Mar 28. doi:10.3390/molecules27072183
5.Marabese I, Boccella S, Iannotta M, et al. Metabotropic glutamate receptor subtype 7 in the dorsal striatum oppositely modulates pain in sham and neuropathic rats. Neuropharmacology. 2018;135:86-99. doi:10.1016/j.neuropharm.2018.03.003
6.Kim ST, Kyung EJ, Suh JS, et al. Phosphatidylcholine attenuated docetaxel-induced peripheral neurotoxicity in rats. Drug Chem Toxicol. 2018;41(4):476-485. doi:10.1080/01480545.2017.1390580
7.Huang F, Chen X, Jiang X, et al. Betaine ameliorates prenatal valproic-acid-induced autism-like behavioral abnormalities in mice by promoting homocysteine metabolism. Psychiatry Clin Neurosci. 2019;73(6):317-322. doi:10.1111/pcn.12833
8.Suzuki T, Sawada T, Kawai K, Ishihara Y. Pharmacological profile of TAN-452, a novel peripherally acting opioid receptor antagonist for the treatment of opioid-induced bowel syndromes. Life Sci. 2018;215:246-252. doi:10.1016/j.lfs.2018.07.028
9.Gias ZT, Afsana F, Debnath P, et al. A mechanistic approach to HPLC analysis, antinociceptive, anti-inflammatory and postoperative analgesic activities of panch phoron in mice. BMC Complement Med Ther. 2020;20(1):102. Published 2020 Mar 30. doi:10.1186/s12906-020-02891-x
10.Palazzo E, Boccella S, Marabese I, et al. Homo-AMPA in the periaqueductal grey modulates pain and rostral ventromedial medulla activity in diabetic neuropathic mice. Neuropharmacology. 2022;212:109047. doi:10.1016/j.neuropharm.2022.109047





甩尾測(cè)試儀(甩尾儀)
準(zhǔn)確測(cè)量大鼠或小鼠的尾巴對(duì)紅外熱刺激的痛覺(jué)閾值,具有極高的可重復(fù)性,對(duì)于麻醉動(dòng)物同樣適用。021-35183767 公眾號(hào)
公眾號(hào) 關(guān)注我們
關(guān)注我們 產(chǎn)品詳情
產(chǎn)品詳情準(zhǔn)確測(cè)量大鼠或小鼠的尾巴對(duì)紅外熱刺激的痛覺(jué)閾值,具有極高的可重復(fù)性,對(duì)于麻醉動(dòng)物同樣適用。
疼痛甩尾法起源于D'Amour&Smith 1941年的發(fā)現(xiàn),通過(guò)持續(xù)聚焦光束在動(dòng)物尾巴上造成熱刺激,當(dāng)動(dòng)物感到疼痛時(shí),會(huì)出現(xiàn)典型的尾巴突然抽動(dòng)現(xiàn)象,且具有很高的重復(fù)性。
Ugo Basile甩尾測(cè)試儀可準(zhǔn)確測(cè)量大小鼠尾部對(duì)紅外熱刺激的傷害感受敏感性。通過(guò)測(cè)量對(duì)紅外熱輻射的疼痛反應(yīng)時(shí)間長(zhǎng)短差異進(jìn)行快速篩選鎮(zhèn)痛藥物。標(biāo)配型號(hào)用于大鼠,不包含固定桶,可選小鼠固定筒用于小鼠甩尾測(cè)試。
甩尾測(cè)試儀主要由一個(gè)紅外光輻射源,鼠固定筒、控制主機(jī)構(gòu)成,將鼠尾巴放置于紅外光發(fā)射窗口處,設(shè)定好光強(qiáng)后,紅外光通過(guò)凸透鏡聚焦在鼠尾上。當(dāng)老鼠感到疼痛并擺動(dòng)尾巴時(shí),傳感器會(huì)檢測(cè)到終點(diǎn)事件,停止計(jì)時(shí)并自動(dòng)記錄時(shí)長(zhǎng)。

優(yōu)勢(shì)特點(diǎn):
一、中樞神經(jīng)鎮(zhèn)痛藥物篩選的經(jīng)典設(shè)備
中樞神經(jīng)疼痛常涉及脊柱生物化學(xué)變化,疼痛部位常擴(kuò)展到身體多部位,甩尾測(cè)試儀可對(duì)中樞神經(jīng)疼痛鎮(zhèn)痛藥物進(jìn)行快速篩選,在已發(fā)表的SCI論文中引用Ugo Basile 甩尾測(cè)試儀已超過(guò)3000次,是全球使用和驗(yàn)
證最多的疼痛甩尾設(shè)備。
二、測(cè)試結(jié)果真實(shí)性高,鼠尾熱痛絕佳測(cè)試方案
Ugo Basile甩尾測(cè)試儀以D'Amour & Smith方法為設(shè)計(jì)理念,結(jié)合了點(diǎn)刺激和熱刺激的優(yōu)勢(shì),具有對(duì)敏感的鼠尾部位不產(chǎn)生交互行為的特點(diǎn),消除了動(dòng)物應(yīng)激反應(yīng),降低了假陽(yáng)性反應(yīng)的甩尾現(xiàn)象,保證測(cè)試結(jié)
果的真實(shí)性和可重復(fù)性。
三、紅外刺激光強(qiáng)可調(diào),自動(dòng)或手動(dòng)評(píng)分
紅外刺激光強(qiáng)可設(shè)置范圍為:1%-100%,適用不同動(dòng)物模型。設(shè)備可自動(dòng)檢測(cè)并存儲(chǔ)由疼痛引起的甩尾時(shí)間,也可采用腳踏開(kāi)關(guān)手動(dòng)停止計(jì)時(shí),常用于甩尾難以自動(dòng)測(cè)量的情況。
四、可視化觸摸屏控制和直觀的結(jié)果顯示
4.3"觸屏控制,具有廣泛的參數(shù)設(shè)置范圍、用戶友好的觸屏控制模式和直觀的結(jié)果顯示,測(cè)試結(jié)果實(shí)時(shí)存儲(chǔ)并可于屏幕上直觀查閱,也可通過(guò)U盤(pán)一鍵導(dǎo)出電子表格方便保存和數(shù)據(jù)處理。


應(yīng)用領(lǐng)域:
甩尾測(cè)試儀可以準(zhǔn)確測(cè)量大小鼠尾巴對(duì)紅外熱刺激的疼痛閾值,廣泛應(yīng)用于疼痛炎癥相關(guān)機(jī)制研究,各類(lèi)中樞神經(jīng)痛及外周神經(jīng)痛的藥物鎮(zhèn)痛效果評(píng)價(jià)。


型號(hào)規(guī)格:
37560
甩尾測(cè)試儀大鼠完整套裝,包含主機(jī)、腳踏開(kāi)關(guān)、U盤(pán)。
37360-325
小鼠固定筒,內(nèi)徑25mm(選配)
37360-330
小鼠固定筒,內(nèi)徑30mm(選配)
37300
紅外光測(cè)量?jī)x校準(zhǔn)計(jì)(選配)
參考文獻(xiàn):
1.Guida F, Boccella S, Belardo C, et al. Altered gut microbiota and endocannabinoid system tone in vitamin D deficiency-mediated chronic pain. Brain Behav Immun. 2020;85:128-141. doi:10.1016/j.bbi.2019.04.006
2.Xue N, Wu X, Wu L, Li L, Wang F. Antinociceptive and anti-inflammatory effect of Naringenin in different nociceptive and inflammatory mice models. Life Sci. 2019;217:148-154. doi:10.1016/j.lfs.2018.11.013
3.Hu ZJ, Han W, Cao CQ, Mao-Ying QL, Mi WL, Wang YQ. Peripheral Leptin Signaling Mediates Formalin-Induced Nociception. Neurosci Bull. 2018;34(2):321-329. doi:10.1007/s12264-017-0194-2
4.Pieretti S, Saviano A, Mollica A, Stefanucci A, Aloisi AM, Nicoletti M. Calceolarioside A, a Phenylpropanoid Glycoside from Calceolaria spp., Displays Antinociceptive and Anti-Inflammatory Properties. Molecules. 2022;27(7):2183. Published 2022 Mar 28. doi:10.3390/molecules27072183
5.Marabese I, Boccella S, Iannotta M, et al. Metabotropic glutamate receptor subtype 7 in the dorsal striatum oppositely modulates pain in sham and neuropathic rats. Neuropharmacology. 2018;135:86-99. doi:10.1016/j.neuropharm.2018.03.003
6.Kim ST, Kyung EJ, Suh JS, et al. Phosphatidylcholine attenuated docetaxel-induced peripheral neurotoxicity in rats. Drug Chem Toxicol. 2018;41(4):476-485. doi:10.1080/01480545.2017.1390580
7.Huang F, Chen X, Jiang X, et al. Betaine ameliorates prenatal valproic-acid-induced autism-like behavioral abnormalities in mice by promoting homocysteine metabolism. Psychiatry Clin Neurosci. 2019;73(6):317-322. doi:10.1111/pcn.12833
8.Suzuki T, Sawada T, Kawai K, Ishihara Y. Pharmacological profile of TAN-452, a novel peripherally acting opioid receptor antagonist for the treatment of opioid-induced bowel syndromes. Life Sci. 2018;215:246-252. doi:10.1016/j.lfs.2018.07.028
9.Gias ZT, Afsana F, Debnath P, et al. A mechanistic approach to HPLC analysis, antinociceptive, anti-inflammatory and postoperative analgesic activities of panch phoron in mice. BMC Complement Med Ther. 2020;20(1):102. Published 2020 Mar 30. doi:10.1186/s12906-020-02891-x
10.Palazzo E, Boccella S, Marabese I, et al. Homo-AMPA in the periaqueductal grey modulates pain and rostral ventromedial medulla activity in diabetic neuropathic mice. Neuropharmacology. 2022;212:109047. doi:10.1016/j.neuropharm.2022.109047
更多推薦 選擇區(qū)號(hào)
選擇區(qū)號(hào)







 瀏覽器自帶分享功能也很好用哦~
瀏覽器自帶分享功能也很好用哦~